Очистка сточных вод от
тяжелых металлов
Методы очистки сточных вод от ионов тяжелых металлов
На выбор определенного метода очистки влияют концентрация и компоненты стоков с содержанием тяжелых металлов, вид производства, возможность применения той или иной технологии очистки. На разных этапах извлечения ионов применяется тот метод, который является наиболее эффективным и экономически менее затратным. Такими являются:
- реагентный;
- сорбционный;
- ионообменный;
- электрохимический;
- обратный осмос и нанофильтрация.
Реагентные методы
Реагентный метод очистки сточных вод от тяжелых металлов предполагает химическое превращение высокотоксичных растворов в нетоксичные соединения. Реагентами могут выступать гидроксиды K и Na, карбонат Na, сульфиды Na.
Если в растворе содержатся вещества, которые способны легко восстанавливаться, тогда прибегают к методу восстановительной очистки. Для этих целей используют сульфат железа, диоксид серы, гидросульфит натрия.
Осаждение ионов тяжелых металлов осуществляют с помощью известкового молока, раствора едкого натра и соды. При применении NaOH необходимо строго контролировать величину рН и подбирать оптимальную дозировку. Использование соды в случае, когда стоки загрязнены такими металлами, как Zn, Pb, Cu и Cd, приводит к образованию основных карбонатов, состав которых зависит от условий реакции: температуры, концентрации раствора, рН и пр.
ZnCl₂ + 2Na₂CO₃ = 2ZnCO₃ + 4NaCl
2ZnCO₃ + H₂O = (ZnOH)₂CO₃ + CO₂
2ZnCl₂ + 2Na₂CO3 + H₂O = 4NaCl + CO₃+ (ZnOH)₂CO₃
Для повышения результатов очистки металлосодержащих стоков целесообразно использовать коагулянты и флокулянты. Коагулянтами могут выступать соли Fe, Al или их смеси.
Наибольшее распространение среди солей Al получили Al₂(SO₄)₃ и NaAlO₂. Сульфат алюминия экономически выгоден, кроме того легко растворяется в воде и дает хороший результат при рН 5 — 7,5. Алюминат натрия при рН 9,3 — 9,8 образует хлопья, способные к быстрому осаждению. Чаще всего применяют смесь солей алюминия, что позволяет расширить диапазон значений рН, повысить скорость образования хлопьев и увеличить их плотность.
Из солей железа чаще всего применяют сульфат железа, хлорное железо, соли трехвалентного железа. Но из-за высокой коррозионной способности и меньшего эффекта хлопьеобразования, соли железа имеют не такое широкое распространение или их используют в смеси с солями алюминия.
Применение титанового коагулянта позволяет довести степень очистки стоков от тяжелых металлов до 50 — 67%.
Флокулянтами могут выступать природные (крахмал, декстрин, эфиры), неорганические (диоксид кремния), синтетические (полиакриламид) вещества.
Недостатками реагентного метода являются:
- высокая стоимость реагентов при их большом расходе;
- повторное загрязнение очищенных вод, что исключает ее возврат в цикл оборотного водопользования;
- утрата ценных веществ и затруднение их переработки;
- образование большого количества осадков.
Хотя исходный состав металлосодержащих стоков не играет существенной роли для качества их очистки реагентным методом, все же требуется доочистка на электродиализаторах или ионообменных фильтрах перед сбросом в водоемы хозяйственно-бытового назначения.
Ионный обмен
При использовании метода ионного обмена получаемое качество очистки позволяет использовать очищенные воды от тяжелых металлов в оборотном цикле водопользования. Метод предполагает обмен между ионами в растворе и ионами на поверхности твердой фазы — ионита. В качестве ионитов чаще всего используют синтетические ионообменные смолы.
С помощью ионного обмена производится глубокая очистка загрязненных стоков от ионов тяжелых металлов: Zn, Cu, Cr, Ni, Pb, Hg, Cd и цианидов.
Основным недостатком метода ионного обмена является вторичное загрязнение сточных вод после восстановления, когда возникает необходимость их обезвреживания.
Нанофильтрация
При нанофильтрации используются мембраны с отверстиями в несколько нм. Для таких мембран используют пористые материалы: ароматические полиамиды, ацетат целлюлозы, керамику.
Способ очистки металлосодержащих сточных вод на нанофильтрационных мембранах заключается в движении воды вдоль мембранной поверхности и смывании загрязнений. Такие мембраны имеют сниженную селективность и большую проницаемость.
Нанофильтрация дает хороший результат на заключительном этапе очистки стоков от загрязнений ионами тяжелых металлов.
Очистка сточной воды от тяжелых металлов
Клименко Татьяна Всеволодовна
Черкасский государственный технологический университет
старший преподаватель кафедры химии и химической технологии неорганических веществ
Аннотация
Данная статья посвящена проблемам извлечения тяжелых металлов из сточных вод и воздействия их на организм человека. Проведенные исследования позволяют утверждать, что метод ультрафильтрации является простым, эффективным и энергосберегающим при очистке сточных вод от хрома (VI) и железа, а использование активированных бентонитовых глин позволит увеличить степень очистки сточных вод от хрома (VI) и предложить ее в качестве промышленного сорбента за счет дешевизны и доступности. Данные исследования являются актуальными и вносят новизну в процесс очистки сточных вод.
Klimenko Tatiana Vsevolodovna
Cherkasy State Technological University
Senior Lecturer, Department of Chemistry and Chemical Technology of Inorganic Substances
Abstract
This article focuses on the heavy metals extraction methods from wastewater and their impact on the human body . Our studies suggest that the ultrafiltration method is simple, effective and energy-efficient wastewater treatment of chromium (VI) and iron, and the use of activated bentonite clays will increase the degree of purification of waste water from chromium (VI) and offer it as an industrial sorbent for due to cheapness and availability. These studies are relevant and makes improvements to the wastewater treatment process.
Библиографическая ссылка на статью:
Клименко Т.В. Очистка сточных вод от ионов тяжелых металлов // Современные научные исследования и инновации. 2013. № 11 [Электронный ресурс]. URL: https://web.snauka.ru/issues/2013/11/28484 (дата обращения: 01.07.2022).
К тяжелым металлам относится больше 40 химических элементов периодической системы Д. И. Менделеева.
Тяжелыми металлами являются хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, молибден, кадмий, олово, сурьма, теллур, вольфрам, ртуть, таллий, свинец, висмут и другие.[1]
Сточные воды, содержащие тяжелые металлы (промышленные сточные воды), образуются в автомобильной и химической промышленности, при производстве гальванических элементов и обработке металлических поверхностей, в электронной промышленности, в типографии, на кожаных фабриках и других. Они представляют большую опасность для окружающей среды и для человека.[1]
Проблема удаления тяжелых металлов из сточных вод сейчас особенно актуальная. Плохо очищенные сточные воды поступают в природные водоемы, где тяжелые металлы накапливаются в воде и донных отложениях, становясь таким образом источником вторичного загрязнения. Соединения тяжелых металлов сравнительно быстро распространяются по объему водного объекта. Частично они выпадают в осадок в виде карбонатов, сульфатов, частично адсорбируются на минеральных и органических осадках. Вследствие чего содержание тяжелых металлов в отложениях постоянно увеличивается, и когда адсорбционная способность осадков исчерпывается, тяжелые металлы поступают в воду, что и приводит к экологическому кризису. Штрафные санкции за сброс тяжелых металлов в воду становятся все жестче, но это не решает проблемы.[1]
Тяжелые металлы поступают в организм человека с едой и водой, накапливаются там, поскольку не выводятся из организма, и вызывают различные заболевания. В небольших дозах железо, цинк и другие металлы жизненно необходимые, потому что участвуют в разных формах метаболизма, переносе, синтезе веществ. Но в концентрациях превышающих предельно допустимые эти металлы становятся вредными, поэтому сточные воды необхио очищать от тяжелых металлов.
Была проведена работа по очистке искусственных образцов сточной воды от железа (Fe) и хрома Cr (VI), которые относятся к 3 классу опасности (опасные). Предельно – допустимая концентрация хрома общего (Cr) в питьевой воде не должна превышать 0,05 мг/дм 3 , а железа общего (Fe) – 0,2 мг/дм 3 [2, приложение 2].
Соединения хрома Cr (VI) в больших концентрациях являются канцерогенными и могут вызывать онкологические заболевания, разные заболевания кожи [3].
Повышенное содержание железа в организме человека приводит к нарушению обмена веществ за счет того, что будучи биологически активным элементом образует хелатоподобные комплексы с обычными метаболитами; взаимодействует с клеточными мембранами, изменяя их проницаемость.
Существует много методов очистки воды от тяжелых металлов, к которым относятся химические, электрохимические, адсорбционные, ионообменные методы и другие. Важной задачей очистки сточных вод является применение наиболее энергосберегающих методов, а также возвращения извлеченных из сточных вод металлов обратно в производство.
Очистка искусственных образцов сточной воды от хрома Cr (VI) проводилась методами ультрафильтрации, адсорбции и ионного обмена, тога как очистка от железа (Fe) проводилась методом ультрафильтрации.
Метод мембранного разделения, а именно ультрафильтрация, является простым и энергосберегающим. Метод заключается в пропускании раствора под давлением через полупроницаемую мембрану. Вследствие чего над мембраной образуется концентрат, содержащий тяжелые металлы, а под мембраной – очищенный раствор (пермеат) [4, с. 326].
Работа по очистке искусственных образцов сточной воды от железа (Fe) и хрома Cr (VI) проводилась на мембранной установке типа УСФ-293. В процессе работы использовались обратноосмотические ацетатцеллюлозные мембраны типа МГА-90, МГА-100 с анизотропной структурой. В результате мембранного разделения был получен пермеат сточных вод, содержащий незначительную концентрацию железа (Fe) и хрома Cr (VI).
Определение концентрации железа (Fe) и хрома Cr (VI) проводилось по стандартным методикам.
Результаты проведенных опытов занесены в таблицы 1, 2.
Очистка искусственных образцов сточной воды от хрома Cr (VI) проводилась также на природных сорбентах, в качестве которых использовалась активированная глина Черкасского месторождения, и на катионите КУ – 2 – 8.
Результаты проведенных опытов занесены в таблицы 3, 4.
Таблица 1 – Результаты очистки сточных вод от железа (Fe) методом ультрафильтрации
Очистка сточной воды от тяжелых металлов
Загрязнение водной среды ионами тяжелых металлов опасно для всей биосферы, а также свидетельствует о расточительном отношении к ресурсам. Со сточными водами гальванотехники теряется более 50 % металлов, предназначенных для декоративных, защитных и других покрытий. Кроме того тяжелые металлы оказывают токсичное воздействие на живые и растительные организмы, имеют тенденцию к накапливанию в пищевых цепочках, что усиливает их опасность для человека. Наиболее опасны ионные комплексные формы тяжелых металлов. Медь, марганец, кобальт, никель, цинк, кадмий, железо, хром относятся к группе токсичных тяжелых металлов. Это вызывает необходимость строгого контроля за их поступлением в окружающую среду, что требует на практике использования сравнительно недорогих, доступных методов их улавливания.
Промышленные сточные воды многих химических, текстильных, машиностроительных, электротехнических заводов, предприятий цветной металлургии и других отраслей промышленности в большей или меньшей степени загрязнены солями цветных и тяжелых металлов. Наиболее часто они загрязнены солями цинка, кадмия, меди, хрома, никеля, ртути, железа реже содержат кобальт, марганец. В сточных водах практически никогда не содержится только один вид катионов, а содержится смесь нескольких солей минеральных кислот. Чаще всего наряду с солью цветного металла содержатся соли железа, а также соляная кислота.
С каждым годом расширяется сфера использования редких металлов – это радиоэлектроника, металлургия, авиация, химическая промышленность. Высокая стоимость, сложность переработки редких металлов привели к необходимости получения тонких металлических пленок на поверхности деталей. Для этой цели в настоящее время в гальванической технике используются такие редкие металлы как индий, молибден, германий, галлий и таллий. Промывные воды, как правило, содержат достаточное количество этих элементов, что требует разработки новых способов их извлечения. Появилась необходимость решения ряда технических, экономических и экологических проблем.
Эффективность и экономичность извлечения ионов цветных, тяжелых и редких металлов из сточных вод методом ионного обмена зависит от их концентрации в воде, рН, общей минерализации воды.
Гальваническое производство относится к разряду весьма опасных источников загрязнения окружающей среды. Существует необходимость, рассматривать варианты бессточных систем водоиспользования с максимально возможным сокращением расхода свежей воды на промывку деталей.
Ионообменная очистка сточных вод от ионов металлов получает все большее распространение. С экономической точки зрения наиболее целесообразна ионообменная очистка не общего стока гальванического производства, а сточных вод, образующихся в отдельных технологических процессах и операциях и содержащих как можно меньше количества металлов и кислот. В этом случае переработка и возврат в производство концентрированных растворов, образующихся при регенерации ионитов и содержащих различные химические продукты, вызывает наименьшие трудности.
Ионообменные методы регенерации позволяют не только полностью извлекать цветные, тяжелые и редкие металлы из отработанных растворов, но также получать продукты регенерации в виде чистых солей металлов, пригодных для повторного использования в производстве с целью приготовления заново и корректировки работающих электролитов. Кроме того, получаемая после ионообменной обработки очищенная вода в большинстве случаев без дополнительной обработки может быть использована в качестве оборотной. Таким образом, использование ионообменных методов с целью регенерации металлов позволяет достичь практически безотходной технологии в гальванических производствах.
При обратимости ионного обмена процессы сорбции и десорбции являются взаимосвязанными. Условия, влияющие на процесс сорбции, оказывают влияние и на процесс десорбции, то есть определяют легкость и полноту десорбции ионов из катионита раствором того или иного электролита, расход и степень использования регенерирующего раствора. Скорость и полнота вымывания определяется не только свойствами сорбированного иона (заряд, размер, степень гидратации, способность образовывать комплексные ионы), но и свойствами иона соли или кислоты элюента, его ионообменным сродством к иониту данного типа, его концентраций.
В настоящей работе при исследовании процесса десорбции ионов металлов из фосфорнокислого катионита КФП-12 использованы растворы HCL, H2SO4, NH4Cl, (NH4)2SO4. Процесс вымывания катионов металлов зависит от типа электролита, способности его вступать в реакции комплексообразования с сорбированными катионами, рН среды и концентрацией ионов металла в элюате.
В водных растворах соляная и серная кислоты ведут себя как сильные электролиты, степень диссоциации 0,1 растворов соответственно равны 0,9 и 0,6. Серная кислота представляет собой двухосновную кислоту, ступенчатые константы диссоциации при температуре 25 °С (μ = 0) равны K1 = 1∙103 и K2 = 1,2∙10–2 [1]. Диссоциацию серной кислоты выражаются уравнениями:
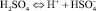
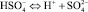
В зависимости от концентрации серной кислоты в растворах изменяется ионный состав [1]. Серная кислота в растворах менее диссоциирована в растворах, по сравнению с соляной кислотой. В таблице приведены данные по свойствам водных растворов соляной, серной кислот и их солей.
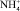
Приведенные данные по свойствам водных растворов кислот и солей показывает, что общим для них является вытесняющий катион H+ или (для солей). В результате разной степени диссоциации данных соединений наблюдается различие концентрации катионов и рН среды. Например, в ряду солей аммония степень диссоциации и, следовательно, концентрация свободных ионов аммония значительно уменьшается в ряду:
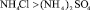
Отмеченные различия существенны и должны оказывать большое влияние на поведение катионов металлов при их вымывании из катионита КФП-12. Для катионов, связанных с функциональными группами катионита ионной связью определяющую роль в элюирующем растворе играет концентрация вытесняющего иона. Слабокислотный катионит КФП-12 обладает высоким сродством к ионам водорода и низкое к ионам аммония. Это обуславливает различие в вымывающей способности растворов минеральных кислот и аммонийных солей по отношению к ионам металлов, если последние не образуют хлоридных или сульфатных комплексов. В противном случае будет сказываться на вымывании прочность комплексных соединений. Например, медь (II), кобальт и никель образуют анионные хлоридные комплексы при концентрациях соляной кислоты соответственно: 4,0; 6,5 и 10–11 моль/дм3. Поведение катионов, связанных с ионогенной группой ионно-координационной связью, будет определяться рН среды и прочностью комплексов, образующихся при взаимодействии катиона металла с элюирующим раствором. В кислой среде возможно разрушение комплекса металла с ионогенной группой.
Коэффициенты активности соляной, серной кислот и их аммонийных солей в водных растворах при 25 °С [2]
Источник https://www.vo-da.ru/articles/ochistka-ot-tyazholyh-metallov/metody-ochistki
Источник https://web.snauka.ru/issues/2013/11/28484
Источник https://top-technologies.ru/ru/article/view?id=31338
